日本人の平均寿命、男性81歳、女性87歳2022年統計なっております。下記のデーターより、平均寿命以上まで生きると、大半はの人は認知症になるという時代です。なので、老後は認知症になる事を想定して、人生設計をしておくことも考えてみるべきだと思います。
下記のGPTの説明を参考に、予防に努めるのはもちろんですが、発症してしまった場合の選択肢の一つに、最近、鳴り物入りで登場した、治療薬レケンビについて下記に紹介してみました。この製剤はアルツハイマー病の原因メインである、アミロイドβペプチドを標的とした抗体です。アミロイドβが脳内に蓄積することを防ぎ、神経細胞の損傷を軽減することを目的としています。軽度アルツハイマー病患者に対して使用されます。脳内のアミロイドβプラークを減少させる効果があります。
アミロイドβの蓄積は、アルツハイマー病の進行に関与しているため、その減少は病気の進行を遅らせる可能性があります。その具体的な効果は、下記のエーザイさんのホームぺージ説明を参考にしてください。
月額約30万位の医療費がかかり、2週1回医療機関に通院して点滴の必要があり、その期間は1年半となっています。高額療養費が適応されますので、70歳代の方であれば、月額2万程度の自己負担で済みます。その効果ですがプラセボと比べて約半年間進行レベルを抑える程度です。しかし、アミロイドβの変化量は劇的でプラセボに比べ約60%減少しています。主原因の大半を除去している意義は大きいと思います。ある程度の副作用が20%位あることはリスク考慮に入れておくべきです。
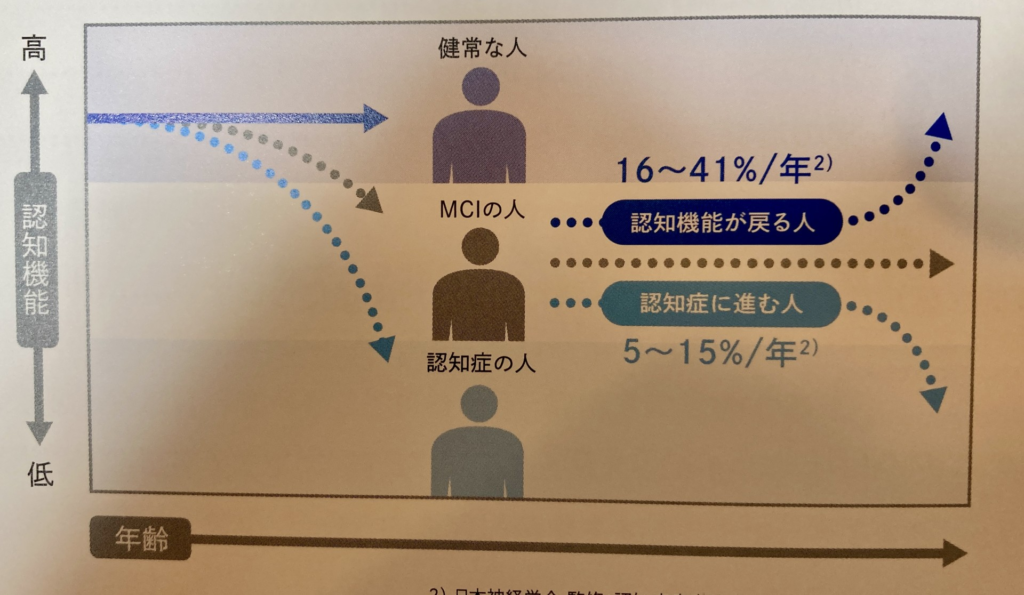
下記の写真は認知症ガイドライン2017より抜粋した資料ですが、自然な状態で軽度認知症から認知症に進む人は最大で年15%程度で、その主原因を取り除いたのであれば、治療を受けた人はこの割合が理論上はもっと減少するはずです。それに関しては、今後の臨床結果を見てみないとわからないというのが現状です。
ただ、今まで治療方法がなかった認知症に新たな希望、選択肢ができたのは大きいと思います。より簡便に投与できるよう、自宅で接種できる自己注射を開発中との話も聞いています。また、10年たつと特許が切れて薬価が下がっていきますので、自己負担も少なくなっていきます。
どちらにしてもその希望の薬を、医薬品ではいつも世界の後塵を拝していた、日本のメーカーがメジャーな疾病で世界に先駆けて新製品を発売した意義は大きく、それが今回の総理大臣賞につながったのだと思います。
トータル医療費は1人、540万円、自己負担36万位かかります。そのため、世界的に富裕層から接種されることが想定されます。ここは、お金持ちに頑張ってもらって、どの様な臨床結果が出るのかデーターを蓄積頂くのが、ベターだと思います。お金持ちは批判の対象になりがちですが、このような状況ではとても貴重な、高貴な存在と改めて思います。
*下記のGPT説明に関して、書籍等である程度正確か確認しました。
認知症について
1. 発症機序
認知症は、脳の神経細胞が損傷または死滅することによって引き起こされる症状の総称です。主な発症機序には以下があります。
- アミロイドβの蓄積: アルツハイマー病において、アミロイドβプラークが脳内に蓄積し、神経細胞の機能を阻害します。
- タウタンパク質の異常: タウタンパク質が異常にリン酸化され、神経細胞内にタウ繊維が形成され、細胞死を引き起こします。
- 血流障害: 脳血管性認知症では、脳の血流が不足し、神経細胞が損傷を受けます。
- 神経炎症: 脳内の炎症反応が神経細胞に悪影響を及ぼすことがあります。
2. 年代ごとの有病率
- 65歳以上:
- 約10-15%が認知症を患っています。
- 75歳以上:
- 約20-30%が認知症を持つとされています。
- 85歳以上:
- 有病率は約30-50%に上昇します。
3. リスクファクター
- 年齢: 高齢になるほどリスクが増加。
- 遺伝要因: 特定の遺伝子(例:APOE ε4型)がリスクを高める。
- 生活習慣:
- 高血圧、糖尿病、高コレステロールなどの心血管疾患。
- 喫煙や過度のアルコール摂取。
- 教育水準: 教育水準が低いとリスクが高くなる傾向があります。
- 社会的孤立: 社会的なつながりが少ないこともリスク要因とされています。
4. 予防方法
- 健康的な食事: 地中海式食事(果物、野菜、魚、ナッツ、オリーブオイルなど)を推奨。
- 定期的な運動: 有酸素運動や筋力トレーニングを含む。
- 知的活動: 読書やパズル、楽器演奏など、脳を活性化させる活動。
- 社会的交流: 友人や家族との交流を持つこと。
- 健康管理: 高血圧や糖尿病の管理、禁煙、適度な飲酒を心がける。
まとめ
認知症は複雑な病態であり、発症機序やリスクファクターは多岐にわたります。早期の予防策を講じることで、発症リスクを低下させることが可能です。健康的な生活習慣を維持することが重要です。
以下、エーザイさんのホームページより抜粋
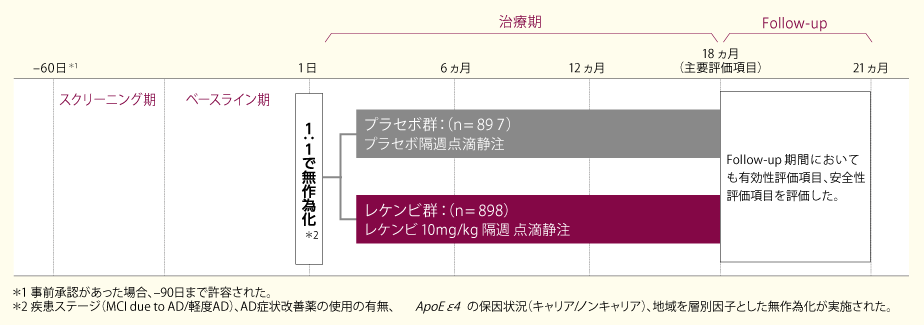
国際共同第III相プラセボ対照比較試験BAN2401-G000-301試験 Core Study(301試験Core Study)(国際共同試験、海外データを含む)
目的
早期アルツハイマー病(早期AD)患者 ※1を対象に、レケンビ10㎎/kg隔週投与のプラセボに対する優越性を検証し、その有効性を評価するとともに、安全性を評価した。
※1:アルツハイマー病による軽度認知障害(MCI due to AD)の可能性が中等度である患者または軽度アルツハイマー型認知症患者
対象
早期AD患者 ※1 1795例(日本人患者152例)
- 軽度アルツハイマー型認知症
- 性別は不問
- 年齢50~90歳
- アミロイドPETまたはCSF検査でアミロイドβ病理を示唆する所見が認められる
方法
スクリーニング期に選定された1795例を無作為化し(プラセボ群897例、レケンビ群898例)、隔週にて18ヵ月間投与した。
プラセボ(プラセボ群)またはレケンビ10mg/kg(レケンビ群)を、それぞれ隔週ごとに60分間かけて点滴静注した。
評価項目
有効性※3
主要評価項目(検証的解析結果)
投与18ヵ月後におけるCDR-SBのベースラインからの変化量 *CDR-SBについては最後に説明
患者背景(SAS※)
| プラセボ群 (n=897) | レケンビ群 (n=898) | ||
|---|---|---|---|
| 診断時の年齢グループn(%) | 30歳以上50歳未満 | 2(0.2) | 2(0.2) |
| 50歳以上65歳未満 | 199(22.2) | 203(22.6) | |
| 65歳以上75歳未満 | 427(47.6) | 395(44.0) | |
| 75歳以上 | 267(29.8) | 298(33.2) | |
| 不明 | 2(0.2) | 0 | |
| 発症後の経過年数(年)b | 不明 | 0 | 1 |
| 平均値(標準偏差) | 4.15(2.518) | 4.14(2.354) | |
| 中央値 | 3.60 | 3.80 | |
| 最小値,最大値 | 0.5,25.6 | 0.4,21.2 | |
| 発症時の年齢(歳)b | 不明 | 0 | 1 |
| 平均値(標準偏差) | 67.6(8.04) | 68.0(8.08) | |
| 中央値 | 68.3 | 68.8 | |
| 最小値,最大値 | 29.9,86.9 | 38,85.7 | |
| 発症時の年齢グループ n(%) | 30歳未満 | 1(0.1) | 0 |
| 30歳以上50歳未満 | 14(1.6) | 20(2.2) | |
| 50歳以上65歳未満 | 284(31.7) | 273(30.4) | |
| 65歳以上75歳未満 | 421(46.9) | 416(46.3) | |
| 75歳以上 | 177(19.7) | 188(20.9) | |
| 不明 | 0 | 1(0.1) | |
b:レケンビ 群 n=897
有効性
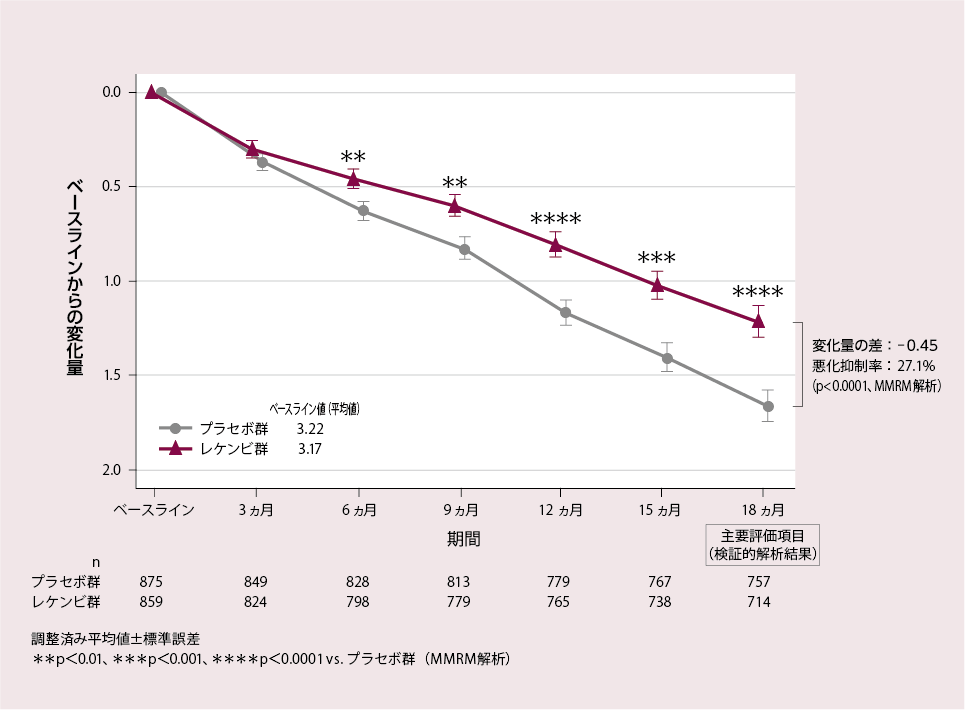
CDR-SBのベースラインからの変化量(各評価時点)[18ヵ月:主要評価項目(検証的解析結果)]
主要評価項目(検証的解析結果)である投与18ヵ月後におけるCDR-SBのベースラインからの変化量(調整済み平均値)は、プラセボ群1.66、レケンビ群1.21、その差は-0.45であり、レケンビ群ではプラセボ群と比較して有意な悪化抑制が示され(27.1%抑制※、p<0.0001、MMRM解析)、レケンビ群のプラセボ群に対する優越性が検証された。
CDR-SBのベースラインからの変化量
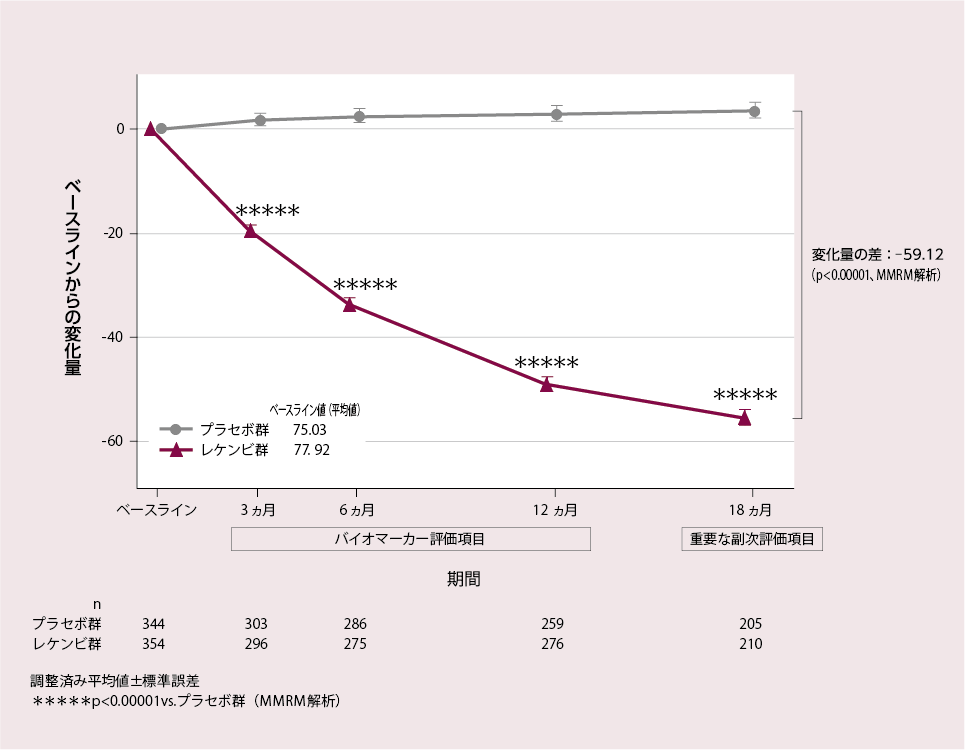
アミロイドPETセンチロイドスケールを指標とした
脳内アミロイドβ蓄積量のベースラインからの変化量(各評価時点)
[18ヵ月:重要な副次評価項目、3、6、12ヵ月:バイオマーカー評価項目]
レケンビ群では、ベースラインのセンチロイドスケールの平均値は77.92であったが、投与18ヵ月後には 22.99となり、アミロイド陽性の閾値である30※を下回った。
アミロイド PET センチロイドスケールのベースラインからの変化量
安全性
副作用
主な副作用(レケンビ群で 2 例以上に発現した事象)
| プラセボ群 (n=897) | レケンビ群 (n=898) | |
|---|---|---|
| 注入に伴う反応 | 64(7.1) | 234(26.1) |
| ARIA-H※1 | 78(8.7) | 148(16.5) |
| アミロイド関連画像異常-微小出血およびヘモジデリン沈着 | 67(7.5) | 122(13.6) |
| 脳表ヘモジデリン沈着症 | 20(2.2) | 47(5.2) |
| 脳出血 | 0 | 4(0.4) |
| アミロイド関連画像異常-浮腫/滲出液貯留(ARIA-E) | 15(1.7) | 113(12.6) |
| 頭痛 | 8(0.9) | 16(1.8) |
| 過敏症 | 6(0.7) | 15(1.7) |
| 疲労 | 3(0.3) | 5(0.6) |
| 発疹 | 1(0.1) | 5(0.6) |
| 浮動性めまい | 5(0.6) | 4(0.4) |
| 注入部位発疹 | 0 | 3(0.3) |
| 悪心 | 0 | 2(0.2) |
| 注入部位血管外漏出 | 3(0.3) | 2(0.2) |
| 注入部位反応 | 1(0.1) | 2(0.2) |
| 転倒 | 2(0.2) | 2(0.2) |
| アラニンアミノトランスフェラーゼ増加 | 2(0.2) | 2(0.2) |
| 高コレステロール血症 | 0 | 2(0.2) |
| 平衡障害 | 1(0.1) | 2(0.2) |
| 記憶障害 | 0 | 2(0.2) |
| 緊張性頭痛 | 0 | 2(0.2) |
| 錯乱状態 | 2(0.2) | 2(0.2) |
| うつ病 | 3(0.3) | 2(0.2) |
| 蛋白尿 | 0 | 2(0.2) |
| 紅斑 | 0 | 2(0.2) |
| 起立性低血圧 | 0 | 2(0.2) |
※1:ARIA-Hには、脳出血、頭蓋内出血、視床出血、脳表ヘモジデリン沈着症、アミロイド関連画像異常-微小出血およびヘモジデリン沈着、小脳微小出血が含まれる(MedDRA Version 25.0)。
有害事象(ARIAに関する有害事象)
レケンビ群における症候性※2ARIA-E、ARIA-Hの有害事象発現率はそれぞれ2.8%(25例)、1.4%(13例)であった。
※2:臨床症状を有する状態。ARIAは臨床症状を伴わないことが多いが、痙攣やてんかん重積等の重篤な事象が起こることがある。ARIAに関連する症状とし ては、頭痛、錯乱、視覚障害、めまい、吐き気、歩行障害等が報告されている。
CDR-SB とは
**CDR-SB(Clinical Dementia Rating Scale Sum of Boxes)**は、認知症の評価に用いられる尺度の一つです。この評価ツールは、認知機能の障害の程度を定量的に測定するために設計されています。
主な特徴
- 評価項目: CDR-SBは、以下の6つの領域に基づいて評価されます。
- 記憶
- 方向感覚
- 判断・問題解決
- 社会的機能
- 家庭の管理
- 趣味や活動
- スコアリング: 各項目は0(正常)から3(重度の障害)までのスコアで評価され、合計スコアが算出されます。合計スコアは0から18までの範囲で、スコアが高いほど認知機能の障害が重いことを示します。
使用目的
- 診断補助: 認知症の診断を補助するために使用されます。
- 進行度の評価: 症状の進行を追跡するためにも利用されます。
- 研究: 認知症に関する研究において、患者群の特性を評価するために広く使用されています。
まとめ
CDR-SBは、認知症の評価において重要なツールであり、医療現場や研究での使用が普及しています。適切な評価を行うことで、患者の状態をよりよく理解し、適切な治療や介護を提供する手助けとなります。
返信がありません